O presente artigo objetiva demonstrar as vantagens da possível aquisição na modelagem de um e-marketplace público de medicamentos pré-qualificados pela OMS ou ANVISA, por serem processos similares, ademais, diante das meticulosas análises realizadas no procedimento de pré-qualificação, o que proporciona padrões de segurança e qualidade dos produtos farmacêuticos. Sobretudo, os medicamentos são bens comuns e padronizados cujos valores são dinâmicos e a mudança da atual modelagem de aquisições proporcionará inúmeras vantagens no âmbito do SUS. Contudo, caso não haja nenhuma mudança expressa na lei nesse sentido, o credenciamento dos referidos insumos para saúde trata-se de ferramenta capaz de romper velhos dogmas para atender plenamente os anseios da sociedade por políticas públicas de saúde com maior celeridade, eficiência, eficácia e economicidade.
Introdução
Inicialmente cumpre consignar que a pré-qualificação no âmbito da Organização Mundial de Saúde – OMS, não segue os mesmos procedimentos da Lei n. 14.133/2021 (Nova Lei de Licitações e Contratos Administrativos – NLLCA), haja vista possuir legislações próprias de caráter compulsório (padrão internacional), para cumprimento das diretrizes das Boas Práticas de Fabricação, devido à natureza crítica da indústria farmacêutica. Contudo, ambas possuem os objetivos de buscar qualidade, segurança e eficácia.
Nesse sentido, é relevante demonstrar que a NLLCA possui a discricionalidade de buscar propostas mais vantajosas de bens, também por intermédio dos procedimentos auxiliares, como exemplos, o credenciamento e a pré-qualificação, este último nos seguintes termos:
Art. 80. A pré-qualificação é o procedimento técnico-administrativo para selecionar previamente:
[…]
II – bens que atendam às exigências técnicas ou de qualidade estabelecidas pela Administração.
Basicamente, a diferença entre a pré-qualificação da Lei n. 14.133/2021 consiste nas análises de exigências técnicas e/ou de qualidade dos insumos, quando já fabricados e postos no mercado para o consumo da população. Por outro lado, a pré-qualificação no âmbito da OMS ocorre na origem, ou seja, é analisado todo o contexto relacionado à fabricação dos insumos farmacêuticos e seu constante monitoramento.
Corrobora com nosso entendimento, Couto et al. (2017):
O processo de pré-qualificação consiste em uma avaliação cientificamente rigorosa e transparente, o que inclui análise das informações de processos (dossiês) apresentadas pelos fabricantes de produtos farmacêuticos e por intermédio de inspeções nas instalações dos respectivos locais de produção, com a devida fiscalização da produção e avaliação de desempenho. Esta informação, em conjunto com outros critérios de adjudicação, é usada pela ONU e outras agências de aquisições para tomar decisões de compra em relação a medicamentos, vacinas, kits diagnósticos e/ou IFA. Esta atividade da OMS, em estreita colaboração com as agências reguladoras nacionais e organizações parceiras, têm como objetivo priorizar o acesso a medicamentos essenciais. (grifos)
Vale destacar que, no Brasil a saúde tem sede constitucional no artigo 196 da CRFB/1988, a qual expressa claramente que a saúde é direito de todos e dever do estado, por isso também possuímos regulamentação sanitária que versa sobre as Boas Práticas de Fabricação – BPF, no intuito de salvaguardar os direitos da população em ter uma saúde de qualidade. Assim sendo, para cumprimento das diretrizes, a Secretaria de Vigilância Sanitária do Ministério da Saúde editou o primeiro normativo a respeito do tema, por meio da Portaria SVS/MS n. 16, de 6 de março de 1995, com posteriores atualizações ao longo do tempo.
Com esse propósito, a Agência Nacional de Vigilância Sanitária – ANVISA, instituída pela Lei n. 9.782/1999, promove a proteção da saúde da população, por intermédio de constante fiscalização/controle sanitário da produção e da comercialização de produtos, medicamentos e serviços submetidos à vigilância sanitária.
Os medicamentos utilizados na rede pública de saúde são adquiridos na maioria das vezes na modalidade pregão, em sua forma eletrônica. Ocorre que dados demonstram que nem sempre há eficiência, por isso, é premente a mudança da modelagem de aquisição para se atingir de forma plena o interesse da coletividade. Ademais, diante de um mundo globalizado de informações dinâmicas, com indústria 4.0 – internet das coisas, computação em nuvem, e-marketplace -, por qual motivo continuamos engessados?
Em âmbito particular a agência nacional de vigilância sanitária – ANVISA, publicou Portaria nº 76, de 9 de fevereiro de 2022, com o objetivo de revisar os requisitos técnicos para a solicitação remota para dispensação de medicamentos, devido o aumento exponência da demanda de plataformas online (marketplaces), impulsionadas a partir da pandemia de Covid-19.
A Importância da Pré-Qualificação da Organização Mundial de Saúde (OMS) em plena pandemia de COVID-19
Com o surgimento da pandemia de Covid-19, o desabastecimento de muitos insumos restou precário, por exemplo, a produção de imunoglobulina humana, a qual o mercado nacional não produz este fármaco na quantidade necessária para suprir suas demandas interna existe há muitos anos (Brasil não é autossuficiente). Assim, para suprir este problema, a ANVISA editou a RDC n. 203/2017, possibilitando a importação da imunoglobulina sem registro no Brasil, desde que respeitados os parâmetros da referida norma. Vale ressaltar que, com o surgimento da pandemia em 2019, a necessidade do fármaco cresceu de maneira exponencial e sua aquisição ocorreu com base na RDC.
Ademais, vale frisar que a busca por uma vacina eficaz foi o ponto primordial para a indústria farmacêutica de todo o mundo há época. Desse modo, decisões precisavam ser tomadas a fim de minimizar o problema da indisponibilidade de IFAs (insumo farmacêutico ativo) componente para fabricação de medicamentos e, sobretudo, devido à urgência na fabricação e aquisição de vacinas para combater a Covid-19.
Nessa toada, em plena pandemia de Covid-19, a ANVISA editou também a RDC n. 563/2021, flexibilizando extraordinariamente, ainda mais, os requisitos para a importação e uso da imunoglobulina humana até 31/07/2022.
Oportuno registrar mais uma vez, que a importação de muitos insumos sem registro na ANVISA para uso imediato da população só foi possível devido à supramencionada RDC n. 203/2017, que em seus artigos 3º e 4º dispõe:
Art.3º Poderão ser autorizados para importação, em caráter de excepcionalidade, os produtos sujeitos à vigilância sanitária cujo fármaco e/ou tecnologia se enquadrem em, pelo menos, uma das seguintes situações:
I – indisponibilidade no mercado nacional, bem como de suas alternativas terapêuticas ou produtos usados para a mesma finalidade devidamente registrados, quando existirem;
II – emergência de saúde pública de importância nacional, nos termos do Decreto n. 7.616, de 2011, ou de importância internacional (ESPII), conforme o Regulamento Sanitário Internacional;
III – vacinas integrantes do Programa Nacional de Imunização, adquiridas por meio do Fundo Rotatório para Aquisições de Imunobiológicos da Organização Pan-americana da Saúde (Opas) /Organização Mundial de Saúde (OMS); ou
[…]
§ 1º Para fins desta Resolução, a indisponibilidade no mercado nacional é caracterizada pela incapacidade, temporária ou definitiva, de atendimento à demanda do Sistema Único de Saúde por detentores de registro devidamente regularizados no país.
[…]
Art. 4º Os produtos a serem importados em caráter de excepcionalidade devem ser pré-qualificados pela Organização Mundial de Saúde (OMS). § 1º Quando o tipo de produto não for objeto de programas de pré-qualificação da OMS, poderá ser autorizada a importação mediante a comprovação de registro válido em país cuja autoridade regulatória competente seja membro do Conselho Internacional para Harmonização de Requisitos Técnicos de Produtos Farmacêuticos de Uso Humano (International Council or Harmonisation of Technical Requirements for Pharmaceuticals for Human Use – ICH) e de certificação de boas práticas de fabricação, ou documento equivalente, do país. (grifos)
A pré-qualificação da Organização Mundial de Saúde é tão importante para o cenário das aquisições públicas no Brasil, que também já foi objeto de análise no Tribunal de Contas da União, por diversas vezes. Vejamos, por exemplo, trecho do Acordão n. 242/2023 – Plenário de relatoria do Ministro Vital do Rêgo:
9.2.1. adote medidas para promover a anulação do Pregão Eletrônico 126/2022 – SRP e, imediatamente, inicie novo processo licitatório para aquisição da imunoglobulina humana 5g, nos termos da Resolução RDC – ANVISA 203/2017, incluindo a participação de empresas estrangeiras com produtos sem registro na ANVISA, nos termos da Resolução RDC-ANVISA 203/2017, que prevê, em seu art. 5º, a necessidade de pré-qualificação pela Organização Mundial de Saúde (OMS) ou a comprovação de registro válido em país cuja autoridade regulatória competente seja membro do Conselho Internacional para Harmonização de Requisitos Técnicos de Produtos Farmacêuticos de Uso Humano (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use – ICH) e de certificação de boas práticas de fabricação, ou documento equivalente, até que a situação excepcional de indisponibilidade de suprimento do fármaco por parte do mercado nacional, em quantidade e em preço razoáveis, esteja comprovadamente superada. (grifos)
Com efeito, Couto et al. (2017) argumentam que, “a OMS busca trabalhar para fortalecer e promover normas, padrões e diretrizes internacionais para a qualidade, segurança e eficácia de medicamentos. Nesse contexto, as Boas Práticas de Fabricação – BPF, como parte integrante da garantia da qualidade, passam a exercer uma relevância ainda maior, quando os produtos são ligados à área de saúde”.
Percebesse que a pré-qualificação da Organização Mundial de Saúde – OMS, possui fundamento no controle efetivo do seu metraprocesso que envolve desde – a aquisição dos insumos farmacêuticos ativos para fabricação, a inspeção nas indústrias farmacêuticas até o monitoramento constante do produto final – por intermédio das agências reguladoras de cada país, portanto nos dar maior segurança.
Pois bem, vejamos como ocorrem as etapas da pré-qualificação no fluxograma da Organização Mundial de Saúde – OMS:
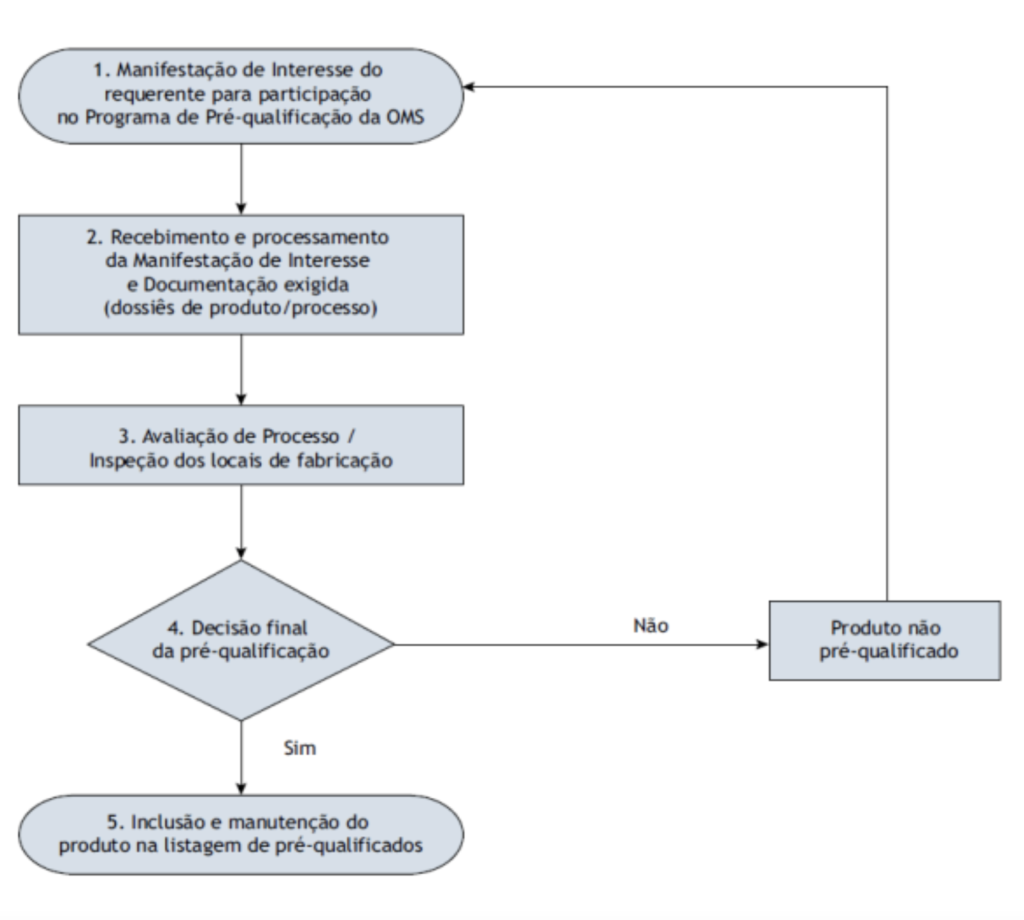
Vislumbramos, pelo fluxo acima, uma rigorosa sequência de atos e protocolos a serem seguidos para que os medicamentos sejam incluídos, bem como para se manterem na listagem de pré-qualificação da OMS.
Nesse intuito, para seguir os protocolos internacionais, o Brasil editou a Resolução n. 17, de 16 de abril de 2010 em virtude da importância da indústria farmacêutica na economia e na política de saúde do país. A referida Resolução revogou outras, sobretudo a Portaria SVS/MS n. 16, de 6 de março de 1995, que foi a primeira norma a tratar do Certificado de Boas Práticas de Fabricação (CBPF) em âmbito nacional.
É sabido que no Brasil a população possui renda média, por isso o acesso a medicamentos e assistência básica de saúde é na maioria das vezes por meio do Sistema Único de Saúde (SUS). Para corroborar, Junior, Oliveira e Fernandes (2023, p. 47), citam que, 71,5% dos brasileiros (cerca de 150 milhões), não possuem qualquer outro serviço de saúde e afirmam ter acesso apenas ao SUS.
Em estudo realizado por Couto et al. (2017), restou evidenciado “alto grau de harmonização acerca dos tópicos/subtópicos comparados entre os guias da OMS e a normatização nacional imposta pela Anvisa em BPF, o que demonstra uma inserção da legislação nacional no contexto internacional, corroborando o alinhamento entre a Anvisa e OMS, no tocante ao cumprimento das BPF”.
O atual modelo de Aquisições de Medicamentos no âmbito do Sistema Único de Saúde – SUS
Na atualidade, os medicamentos no âmbito do SUS são adquiridos em sua maioria por intermédio de licitação, devido ao mandamento Constitucional insculpido no artigo 37, inciso XXI da CRFB/1988, em respeito ao princípio da legalidade que impõe a obrigatoriedade de licitar, salvo as exceções legais.
Vale destacar que, por ser de natureza comum, os medicamentos são adquiridos através da modalidade pregão. Assim, para ilustrar e corroborar com nosso argumento, somente no supramencionado Acordão de n. 242/2023 – Plenário de relatoria do Ministro Vital do Rêgo, o qual se referiu à aquisição de frascos de Imunoglobulina Humana 5g injetável foram citados para fundamentar o v. Acordão vários Pregões (126/2023, 126/2022, 24/2021 075/2020, 134/2020 e 60/2018) no mesmo sentido.
O portal de Compras do governo federal atualizado em 05/01/2024 demonstra, conforme gráfico abaixo, que as aquisições por outra modalidade de licitação, a exemplo da concorrência (1.342), são insignificantes em relação às oriundas por pregão (326.308) Vejamos os números:
Certamente, isso ocorre pelo fato de que mais de 90% das aquisições são de itens comuns e padronizados pelo mercado, logo, por determinação legal, devem ser por pregão, e os medicamentos não fogem à regra.
Todavia, em pesquisa realizada em um grande hospital universitário federal citado, por Junior, Oliveira e Fernandes (2023, p. 52), demostra-se que, de um total de 182 processos licitatórios por pregão eletrônico, 984 itens (49,59%) tiveram a compra fracassada.
Sem adentrar nos motivos para o fracasso dos demais itens, chamou-nos a atenção o número de 29 licitantes que apresentaram o Certificado de Boas Práticas de Fabricação – CBPF com validade vencida; 13 apresentaram o CBPF com endereço diferente do registrado na bula; 7 não apresentaram o CBPF e 3 com o registro do medicamento vencido, logo podemos constatar a importância desse documento de certificação expedido e controlado pelos órgãos competentes como a OMS e ANVISA.
Os referidos autores sustentam, ainda que na modalidade pregão há uma “falsa economia ocasionada por disputas que, muitas das vezes, beiram o razoável, tendo como consequência o problema da seleção adversa que tanto tem assombrado as contratações públicas do país”.
Ainda sobre o pregão, segundo Torres (2024, p. 531), “a utilização do pregão eletrônico, por exemplo, há anos tem gerado redução nos valores das contratações, mas, por outro lado, acentua os problemas na execução contratual e pode fragilizar políticas de beneficiamento do comércio local”.
Acreditamos que os problemas na execução contratual dos processos oriundos dos pregões ocorrem exatamente devido à obrigatoriedade de se utilizar insoladamente o “fetiche” do menor preço como critério para selecionar a proposta “mais vantajosa”. Vale dizer que, por mais que se considere o ciclo de vida, haja excelente especificação do bem com a definição de padrões mínimos de qualidade e, ainda que seja observado o menor dispêndio no julgamento, a prática cotidiana demonstra que continuamos com o problema da seleção adversa (bens, serviços e obras de baixa qualidade).
O professor Nóbrega (2021, p. 19), discorre que a pré-qualificação pode ser excelente instrumento para minorar as assimetrias de informação, no intuito de mitigar seleções adversas, haja vista que revela informações úteis como, idoneidade, capacidade de executar o objeto, confiabilidade, qualidade dos bens, etc.
Nesse contexto, é relevante observar que o processo de pré-qualificação de medicamentos específico da OMS e ANVISA se mostram eficientes, pois consiste em uma avaliação cientificamente rigorosa e transparente, o que inclui análise das informações de processos (dossiês) apresentadas pelos fabricantes de produtos farmacêuticos e por intermédio de inspeções nas instalações dos respectivos locais de produção, com a devida fiscalização da produção e avaliação de desempenho. Logo, atende plenamente ao referido por Nóbrega.
Devido às possíveis desvantagens apontadas no atual modelo de aquisição de medicamentos no cenário nacional, bem como diante das potenciais vantagens na utilização da modelagem de um e-marketplace público para as referidas aquisições, desde que pré-qualificados pela OMS e/ou ANVISA, iremos discorrer sobre o assunto no próximo tópico.
Ruptura da Modelagem de aquisição de Medicamentos no âmbito do SUS por um E-Marketplace Público
Primeiramente convém trazer os argumentos de Nóbrega e Torres (2023, p. 56-57) ao aduzirem que a NLLCA, “repete a lógica burocrática e formalista da legislação anterior, sem refletir sobre as inovações tecnológicas e sociais que impactam e continuarão impactando as formas de comunicação e contratação”.
Sabemos que a Lei n. 14.133/2021 nada aduz a respeito da modelagem de e-marketplace, entretanto, felizmente, a melhor doutrina tem construído argumentos interessantes sobre a temática. Torres (2024, p. 525), brilhantemente argumenta que “a plataforma legal do credenciamento permite avanços neste sentido”.
Camelo, Torres e Nóbrega, conceituam o e-marketplace da seguinte forma:
Um e-marketplace para licitação é um sistema que permite que organizações de compras e seus fornecedores mantenham, de modo eficiente, um resumo das mercadorias e empresas contratadas e facilita os entes públicos a organizar rapidamente as mercadorias e empreendimentos de que necessitam.
A Lei n. 14.133/2021 admite, entre outras, o credenciamento para fornecimento de bens (art. 6º, XLIII), bem como em mercados fluidos, caso em que a flutuação constante do valor da prestação e das condições de contratação inviabiliza a seleção de agente por meio de processo de licitação (art. 79, III).
Já percebemos que, em muitas circunstâncias, a utilização do pregão para aquisições é desvantajosa. Ademais, estudo da Controladoria-Geral da União (2017) constatou que, “no modelo de licitações atual, 85% dos órgãos federais são considerados deficitários, o que significa que mais de 30% dos pregões realizados por eles têm custo administrativo superior à redução no preço decorrente da disputa”.
Nessa senda, resta demonstrado que as aquisições, por pregão, na seara de medicamentos, em muitos casos, é inviável, sobretudo antieconômica. Torres (2020, p. 430), por exemplo, argumenta que “inviável não se caracteriza apenas nas situações em que é impossível a disputa, mas também naquelas em que a disputa é inútil ou prejudicial à pretensão contratual da Administração”.
No que se refere ao viés de mercados fluidos, os medicamentos devido sua alta volatilidade de valores (preços dinâmicos), sobretudo, que em muitos casos a Organização Mundial de Saúde precisa intervir devido aos altos preços e, sobretudo, para que a papulação de baixa renda tenha acesso a medicamentos básicos, vejamos para ilustrar, o exemplo, no caso do tratamento da diabete (2019):
O Programa de Pré-Qualificação de Medicamentos da OMS contribui para acelerar e aumentar o acesso a produtos médicos críticos com garantia de qualidade, preço acessível e adaptados para mercados em países de baixa e média renda. A diabetes está aumentando globalmente e crescendo mais rapidamente em países de baixa renda, disse Tedros Adhanom Ghebreyesus, diretor-geral da OMS. Muitas pessoas que precisam de insulina enfrentam dificuldades financeiras para acessá-la ou ficam sem ela, arriscando suas vidas. A iniciativa de pré-qualificação da OMS é um passo vital para garantir que todos que precisam deste produto, que salva vidas, possam acessá-lo. (grifos)
A aquisição de medicamentos para o consumo diário de pacientes que estão internados na rede pública hospitalar ou o seu recebimento através das farmácias básicas para combater os males de muitas doenças é sem dúvida premente.
Assim, não podemos descartar que as restrições para o amplo abastecimento de medicamentos e insumos nos hospitais em várias situações poderá agravar ainda mais a saúde dos que necessitam de tratamento. Nesse sentido, observem o Acordão n. 693/2014 – Plenário de relatoria do Ministro Benjamin Zymler:
152. O controle de medicamentos e insumos deve estar associado a rotinas e sistemas dinâmicos e interconectados, capazes de acompanhar em tempo integral as aquisições, o controle de estoque, a distribuição e o consumo desses materiais. Falhas em uma destas rotinas acarretam riscos de desabastecimento, que, por sua vez, acarretam restrições de procedimentos e, consequentemente, colocam em risco a vida de pacientes. (grifos)
Desse modo, acreditamos que a modelagem de um e-marketplace público, mesmo não estando disposto na NLLCA, no entanto, felizmente se assemelha ao procedimento auxiliar do credenciamento de bens em mercados fluidos, trata-se de ferramenta capaz de solucionar a falta de abastecimento de muitos medicamentos e contribuirá para aquisições de qualidade com valores mais justos, se ousarmos (solta a poita) para construirmos modelos em que as vantagens superem as desvantagens.
A fim de solucionar esta lacuna legal, não por acaso já existe um Projeto de Lei de n. 2.133/2023 em tramitação, que propõe instituir um Sistema de Compra Instantânea (Cix) que se destina à aquisição, por meio de credenciamento em mercados fluidos, de bens padronizados.
Para embasar o referido projeto de lei, foram apresentados diversos motivos relevantes, que dentre eles, destacamos como exemplo a variação do preço da Dipirona:
A variação de preço da Dipirona, medicamento usado frequentemente para tratar dores e febre, chega a 1.566%, com mínimo de R$ 0,03 e máximo de R$ 0,49. O preço médio é de R$ 0,15, e a mediana, de R$ 0,13. […], a variação de preço entre os cerca de 5 mil compradores é muito grande e poderia ser eliminada se o Estado usasse seu poder de compra. (grifos)
Vale trazer para conhecimento a excelente proposta de alteração à Lei n. 14.133/2021, para inserir dispositivos que possibilitem um Sistema de Compra Instantânea (Cix):
Art. 1º A Lei n. 14.133, de 1º de abril de 2021, passa a vigorar com as seguintes alterações: Art. 75-A. O Sistema de Compra Instantânea (Cix) destina-se à aquisição, por meio de credenciamento em mercado fluido, de bens padronizados e previamente selecionados pela Administração Pública, que serão anunciados no Portal Nacional de Contratações Públicas (PNCP), na forma de regulamento do Poder Executivo federal, que disporá sobre: I – o credenciamento dos anunciantes; II – o cadastramento do bem em catálogo eletrônico de padronização; III – as regras para a formação do preço; IV- os prazos e métodos para entrega e recebimento dos bens; V- o prazo para pagamento, que não poderá ser superior a 30 (trinta) dias contados do recebimento; VI- penalidades pelo inadimplemento do contratado. § 1º Poderão aderir ao Cix: I – os consórcios públicos de que trata a Lei n. 11.107, de 6 de abril de 2005; II – as pessoas jurídicas de direito privado sem fins lucrativos abrangidas pela Lei n. 9.637, de 15 de maio de 1998, pela Lei n. 9.790, de 23 de março de 1999, e pela Lei n. 13.019, de 31 de julho de 2014, na forma de regulamento. § 2º Será permanente o credenciamento de novos interessados. (grifos)
Nóbrega e Torres (2020) comentam muitas das vantagens desta modelagem, “redução dos custos de transação, maior celeridade no atendimento da demanda administrativa, ampla competitividade, melhor conformidade e padronização das compras, maior controle sobre os gastos, menor burocracia e redução de custos processuais repetitivos”.
Com efeito, esperamos que o PL n. 2.133/2023 em breve seja convertido em lei para suprir a lacuna legal, ademais que boa parte da doutrina nos presenteia com argumentos sólidos e didáticos nesse caminho.
Contudo, ainda que à desejada mudança legislativa não venha em tempo, vislumbramos que na atualidade é possível inovar (art. 11, IV) nos exatos termos da Lei n. 14.133/2021 ao dispor que o processo licitatório tem por objetivos além de selecionar proposta mais vantajosa o de incentivar a inovação e o desenvolvimento nacional sustentável.
Por isso, mesmo que ainda não haja a modelagem do e-marketplace público, podemos utilizar o credenciamento de bens em mercados fluidos com essa finalidade, vejamos, para ilustrar, o primor da decisão do TRIBUNAL PLENO – 7/6/2023 do TCE-MG:
Ressalvadas as especificidades aplicáveis a cada espécie, ainda que pendente de regulamentação, é possível a utilização do credenciamento fundado no inciso III do art. 79 da Lei n. 14.133/21 para a contratação de bens comuns tais como medicamentos, material hospitalar, gêneros alimentícios, material de construção, peças e acessórios para veículos automotores e combustíveis, desde que as circunstâncias de aquisição se amoldem às exigências legais e sejam devidamente justificadas, demonstrando-se a vantajosidade do credenciamento para a Administração. Ressalva-se, porém, que a aquisição de medicamentos é regida por normas próprias, e que a manutenção de veículos automotores, incluído o fornecimento de peças, pode ser realizada por contratação direta por meio de dispensa em razão do valor, nos termos do art. 75, I, c/c o § 7º, da citada Lei. (grifos)
Notamos que a respeitável decisão do Tribunal de Contas Mineiro menciona expressamente os medicamentos e faz referência às normas próprias do setor. Já demonstramos o rigoroso controle da pré-qualificação da OMS e harmonização existente quanto à expedição do CBPF pela ANVISA para os medicamentos no Brasil.
Igualmente, em plena pandemia de Covid 19, vários medicamentos, inclusive vacinas, só foram importados, porque são pré-qualificados pela OMS. Não por acaso, Couto et al. (2017) aduzem:
O Programa de Pré-Qualificação de Medicamentos da OMS, criado em 2001, visa avaliar a qualidade, segurança e eficácia dos medicamentos, a fim de otimizar o uso dos recursos em prol da saúde e melhorar os indicadores de saúde pública em regiões desprovidas de assistência farmacêutica básica, ou seja, de medicamentos essenciais, e com populações acometidas por doenças negligenciadas. (grifos)
Conclusão
Diante dos argumentos expostos no presente artigo e, sem a pretensão de esgotar o assunto, visto sua relevância para a Administração Pública, acreditamos que a modelagem de um e-marketplace público para aquisição de medicamentos pré-qualificados pela OMS ou ANVISA, tendo em vista a harmonização entre ambas, sobretudo, diante da meticulosa análise realizada no referido processo de pré-qualificação, o qual garante padrões de segurança e qualidade dos produtos farmacêuticos seria medida disruptiva nas compras públicas.
Contudo, a Lei n. 14.133/2021 nada aduz a respeito da modelagem de um e-marketplace público, entretanto, felizmente a melhor doutrina tem construído argumentos consistentes sobre a temática com a indicação do credenciamento fundamentado no inciso III do art. 79 da Lei n. 14.133/2021 no que tange a contratação de bens comuns, padronizados em mercados fluidos.
Por fim, vale frisar que há proposta de mudança legislativa para possibilitar Compras Instantâneas por intermédio do PL n. 2.133/2023, que caso ocorra será uma grande ruptura na modelagem engessada atual (e.g. requisitos habilitatórios excessivos, meramente cartorários que muita das vezes eleva os custos finais) para possível aquisição de medicamentos padronizados e pré-qualificados.
Contudo, caso não ocorra a referida mudança legislativa nesse sentido, o credenciamento – procedimento auxiliar prévio à contratação é a forma ideal para adquirir os insumos para saúde, pois se trata de ferramenta capaz de romper com velhos dogmas para atender plenamente os anseios da sociedade por políticas públicas de saúde com maior celeridade, segurança, qualidade, eficiência, eficácia e economia.
Referências
BRASIL. Lei de n. 14.133, de 1º de abril de 2021. Lei de Licitações e Contratos Administrativos. Brasília–DF, 01 abr. 2021. Planalto. Disponível em: http://www.planalto.gov.br/ccivil_03/_ato2019-2022/2021/lei/L14133.htm. Acesso em: 18 mar. 2023.
BRASIL. Lei de n. 9.782, de 26 de janeiro de 1999. Define o Sistema Nacional de Vigilância Sanitária, cria a Agência Nacional de Vigilância Sanitária, e dá outras providências. Planalto. Disponível em: https://www.planalto.gov.br/ccivil_03/leis/l9782.htm. Acesso em: 18 mar. 2023.
BRASIL. Constituição da República Federativa do Brasil. Promulgada em 5 de outubro de 1988. Brasília–DF, 05 out. 1988. Disponível em: http://www.planalto.gov.br/ccivil_03/constituicao/constituicao.htm. Acesso em: 20 mar. 2023.
BRASIL. Tribunal de Contas da União. Acórdão n. 242/2023 – Plenário. Disponível em: https://pesquisa.apps.tcu.gov.br/resultado/acordaocompleto/*/NUMACORDAO%253A242%2520ANOACORDAO%253A2023. Acesso em: 27 mar. 2024.
BRASIL. Tribunal de Contas da União. Acórdão n. 693/2014 – Plenário. Disponível em: https://pesquisa.apps.tcu.gov.br/documento/acordao-completo/*/NUMACORDAO%253A693%2520ANOACORDAO%253A2014%2520COLEGIADO%253A%2522Plen%25C3%25A1rio%2522%2520/DTRELEVANCIA%2520desc%252C%2520NUMACORDAOINT%2520desc/0. Acesso em: 28 mar. 2024.
BRASIL. Tribunal de Contas de Minas Gerais. Pleno – Processo 1120202. Disponível em: https://www.tce.mg.gov.br/noticia/Detalhe/1111626511. Acesso em: 18 mar. 2024.
BRASIL. Câmara dos Deputados Federais. PL n. 2.133/2023. Disponível em: https://www.camara.leg.br/proposicoesWeb/fichadetramitacao?idProposicao=2358217. Acesso em: 27 mar. 2024.
BRASIL. Controladoria-Geral da União (CGU). Estudo sobre a eficiência dos pregões realizados pelo Governo Federal. Site oficial Disponível em: https://www.gov.br/cgu/pt-br/assuntos/noticias/2017/07/cgu-divulga-estudo-sobre-eficiencia-dos-pregoes-realizados-pelo-governo-federal. Acesso em: 28 mar. 2024.
BRASIL. Resolução n. 203, de 26 de dezembro de 2017. Disponível em: https://sincamesp.com.br/wp-content/uploads/sites/74/2018/07/U_RS-MS-ANVISA-RDC-203_261217.pdf. Acesso em: 28 mar. 2024.
BRASIL. Resolução n. 563, de 15 de setembro de 2021. Disponível em: https://antigo.anvisa.gov.br/documents/10181/6326437/RDC_563_2021_.pdf/e206010b-c572-42c6-ad0a-f485834fef39. Acesso em: 28 mar. 2024.
BRASIL. Resolução n. 17, de 16 de abril de 2010. Dispõe sobre as Boas Práticas de Fabricação de Medicamentos. Disponível em: https://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2010/res0017_16_04_2010.html#:~:text=Disp%C3%B5e%20sobre%20as%20Boas%20Pr%C3%A1ticas,regulamento%20aprovado%20pelo%20Decreto%20No%2D%20. Acesso em 29 mar. 2024.
BRASIL. Portaria SVS/MS n. 16, de 6 de março de 1995. Disponível em: https://pesquisa.in.gov.br/imprensa/servlet/INPDFViewer?jornal=1&pagina=28&data=09/03/1995&captchafield=firstAccess. Acesso 20 mar. 2024.
CAMELO, Bradson; NÓBREGA, Marcos; TORRES, Ronny Charles L. de. Análise econômica das licitações e contratos: de acordo com a Lei nº14. 133/2021 (nova lei de licitações). Belo Horizonte: Fórum, 2022.
COUTO, Marcus Vinicius Lima do., et al. A pré-qualificação de medicamentos: análise
comparativa entre OMS e Anvisa. Disponível em: https://doi.org/10.22239/2317-269x.00796. Acesso 20 mar. 2024.
JUNIOR. Andryu Antônio Lemos L. OLIVEIRA. Anastácia Nadir Melo de. FERNANDES. Thiago Albuquerque. Estudos Avançados sobre Contratações Públicas. COSTA. et al. (coord.). O uso do credenciamento como medida disruptiva para o desenvolvimento de políticas públicas pelo SUS: Superando o falso paradigma de eficiência do pregão.
NÓBREGA, Marcos. TORRES, Ronny Charles L. de. A nova lei de licitações, credenciamento e e-marketplace o turning point da inovação nas compras públicas. O Licitante 2020. Disponível em https://www.olicitante.com.br/e-marketplace-turning-point-inovacao-compras-publicas.
NÓBREGA, Marcos; JURUBEBA, Diego Franco de Araújo. Assimetrias de Informação na Nova Lei de Licitações e o Problema da Seleção Adversa. Versão atualizada em agosto de 2021 de artigo originalmente publicado na Revista Brasileira de Direito Público – RBDP, Belo Horizonte, ano 18, n. 69, p. 9-32, abr./jun. 2021.
NÓBREGA, Marcos. TORRES, Ronny Charles L. de. Lei n. 14.133/2021, Credenciamento e E-marketplace: O Turning Point da Inovação nas Compras públicas In: ANGRA, Walber de Moura; NÓBREGA, Marcos (org.). Deambulando sobre a Lei de licitações e Contratos Administrativos. Recife: Ed. do Autor, 2023.
PORTAL DA ORGANIZAÇÃO PAN-AMERICANA DE SAÚDE. Disponível em: https://www.paho.org/pt/noticias/14-11-2019-oms-lanca-primeiro-programa-pre-qualificacao-insulina-para-expandir-acesso-ao. Acesso em: 20 mar. 2024.
TORRES, Ronny Charles Lopes de. Leis de licitações públicas comentadas. 11. ed. São Paulo: Juspodvm, 2020.
TORRES, Ronny Charles Lopes de. Leis de licitações públicas comentadas. 15. ed. São Paulo: Juspodvm, 2024.







